Meskipun begitu, definisi ini lebih
tepat karena memang semua senyawa organik mengandung karbon, sementara senyawa
karbon yang bukan organik jenisnya hanya sedikit. Berikut ini tabel yang akan
memberikan gambaran beberapa perbedaan antara senyawa karbon organik dengan
senyawa karbon anorganik.
Gugus Fungsi:

Gugus Fungsi:

Keluarga asam karboksilat mengandung gugus fungsi karboksil (-COOH). Asam asetat merupakan salah satu contohnya.
Konsep mengenai gugus fungsi sangat penting dalam kimia organik,
karena berperan untuk menggolongkan struktur dan untuk memprediksi
karakteristiknya. Gugus fungsi dapat berpengaruh pada sifat fisik dan kimia
suatu senyawa organik. Molekul-molekul dikelompokkan berdasarkan basis gugus
fungsinya. Alkohol, misalnya, memiliki subunit C-O-H. Semua alkohol cenderung
bersifat hidrofilik, biasanya membentuk ester.
I SKEMA SENYAWA ORGANIK
Senyawa alifatik
Hidrokarbon alifatik dapat dibagi menjadi 3 seri homolog
berdasarkan tingkat saturasi:
·
parafin/alkana yang
tanpa ikatan rangkap dua atau ikatan rangkap tiga,
·
olefin atau alkena
yang mengandung satu atau lebih ikatan rangkap dua, contohnya di-olefin (diena)
atau poliolefin.
·
alkuna yang memiliki
satu atau lebih ikatan rangkap tiga.
Selain ini digolongkan berdasarkan gugus fungsi yang ada. Senyawa
yang ada bisa rantai lurus, rantai bercabang, atau siklik. Derajat percabangan
menentukan karakteristiknya.
1. Hidrokarbon
- Termasuk senyawa alifatis (senyawa yang mempunyai rantai karbon terbuka.
- Hanya mengandung unsur hidrogen dan karbon.
- Hidrokarbon dibedakan atas Hidrokarbon jenuh dan hidrokarbon tidak jenuh.
Hidrokarbon jenuh adalah senyawa hidrokarbon yang rantai atom
karbonnya hanya terbentuk melalui ikatan
kovalen tunggal. Yang termasuk
hidrokarbon jenuh adalah golongan Alkana.
Hidrokarbon tidak jenuh adalah senyawa
hiodrokarbon yang rantai atom karbonnya terbentuk melalui ikatan kovalen tunggal dan ikatan kovalen rangkap dua atau kovalen rangkap tiga.
Yang termasuk hidrokarbon tidak jenuh adalah golongan Alkena , Alkadiena dan Alkuna
1) Alkana
Kita telah mempelajari bahwa ikatan tunggal yang terbentuk pada molekul etana adalah karena adanya overlap elektron sigma pada orbital karbon sp3. Senyawa yang hanya memiliki ikatan tunggal karbon-karbon dan karbon-hidrogen, berapapun jumlah atom karbonnya, kita golongkan dalam kelompok senyawa alkana.
CH4 CH3CH3
Metana Etana Isobutana 2,2-Dimethyl-propane
Propana
Alkana biasa disebut dengan senyawa hidrokarbon jenuh. Disebut hidrokarbon karena di dalamnya hanya terkandung atom karbon dan hidrogen. Disebut jenuh karena hanya memiliki ikatan tunggal C-H dan C-C saja. Alkana memiliki rumus umu CnH2n+2, dimana n adalah bilangan asli yang menyatakan jumlah atom karbon. Alkana juga sering disebut sebagai senyawa alifatik (Yunani = aleiphas yang berarti lemak). Hal ini dikarenakan lemak-lemak hewani mengandung karbon rantai panjang yang mirip dengan alkana.
Alkena merupakan senyawa hidrokarbon yang mengandung ikatan rangkap karbon-karbon. Alkena terdapat dalm jumlah berlebih di alam. Etilena, sebagai contohnya, adalah hormon tanaman yang memacu pematangan buah, dan α-pinen adalah senyawa terbanyak dalam turpentin. Contoh lainnya adalah beta karoten, mengandung sebelas ikatan rangkap dua, merupakan pigmen warna kuning yang mewarnai wortel. Beta karoten merupakan pro vitamin A.
Senyawa organohalogen (C, H, X dimana X = F, Cl, Br, atau I). Atom-atom halogen dapat dianggap sebagai pengganti hidrogen, jadi senyawa hidrokarbon seperti C4H6Br2 ekuivalen dengan C4H8, dengan demikian memiliki derajat ketidakjenuhan sama dengan satu.

3. Alkuna
Alkuna adalah senyawa jidrokarbon yang mengandung ikatan rangkap tiga karbon-karbon. Asetilena, adalah alkuna paling sederhana yang digunakan secara industrial sebagai bahan awal pembuatan asetaldehida, asam asetat, dan vinil klorida. Asetilena dibuat dari dekomposisi metana dalam suhu tinggi.
2 CH4 HC CH H2
12000C
+ 3
Metana Asetilena
Struktur Elektronik Alkun Ikatan rangkap tiga dihasilkan dari interaksi karbon-karbon
yang terhibridisasi sp. Ketika dua atom karbon yang terhibridisasi sp saling berinteraksi maka akan terbentuk satu ikatan σ dan dua ikatan π. Telah diketahui bahwa sudut ikatan pada karbon yang terhibridisasi sp adalah 1800, dengan demikian, asetilena C2H2, adalah molekul linear dengan sudut ikatan H C C sebesar 1800. Panjang ikatan karbon-karbon rangkap tiga sebesar 120 pm, dan kekuatan ikatannya sekitar 835 kJ/mol. Jadi ikatan karbonkarbon rangkap tiga memiliki panjang ikatan paling pendek dengan kekuatan paling besar. Hasil eksperimen memperlihatkan bahwa sekitar 318 kJ/mol energi dibutuhkan untuk memutus ikatan pi dalam alkuna, nilai ini kira-kira 50 kJ/mol lebih besar dari yang di butuhkan untuk memutuskan ikatan pi dalam alkuna.
TURUNAN HIDROKARBON
1) Alkana
Kita telah mempelajari bahwa ikatan tunggal yang terbentuk pada molekul etana adalah karena adanya overlap elektron sigma pada orbital karbon sp3. Senyawa yang hanya memiliki ikatan tunggal karbon-karbon dan karbon-hidrogen, berapapun jumlah atom karbonnya, kita golongkan dalam kelompok senyawa alkana.
CH4 CH3CH3
Metana Etana Isobutana 2,2-Dimethyl-propane
Propana
Alkana biasa disebut dengan senyawa hidrokarbon jenuh. Disebut hidrokarbon karena di dalamnya hanya terkandung atom karbon dan hidrogen. Disebut jenuh karena hanya memiliki ikatan tunggal C-H dan C-C saja. Alkana memiliki rumus umu CnH2n+2, dimana n adalah bilangan asli yang menyatakan jumlah atom karbon. Alkana juga sering disebut sebagai senyawa alifatik (Yunani = aleiphas yang berarti lemak). Hal ini dikarenakan lemak-lemak hewani mengandung karbon rantai panjang yang mirip dengan alkana.
Sifat-sifat Alkana
- Hidrokarbon jenuh (tidak ada ikatan atom C rangkap sehingga jumlah atom H nya maksimal)
- Disebut golongan parafin karena affinitas kecil (sedikit gaya gabung)
- Sukar bereaksi
- Bentuk Alkana dengan rantai C1 – C4 pada suhu kamar adalah gas, C4 – C17 pada suhu adalah cair dan > C18 pada suhu kamar adalah padat
- Titik didih makin tinggi bila unsur C nya bertambah…dan bila jumlah atom C sama maka yang bercabang mempunyai titik didih yang lebih rendah
- Sifat kelarutan : mudah larut dalam pelarut non polar
- Massa jenisnya naik seiring dengan penambahan jumlah unsur C
- Merupakan sumber utama gas alam dan petrolium (minyak bumi)

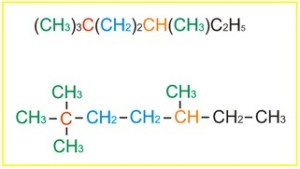
CH3 (warna hijau) merupakan ujung rantai
CH2 (warna biru) merupakan bagian tenganh rantai lurus
CH (warna oranye) percabangan tiga
C (warna merah) percabangan empat
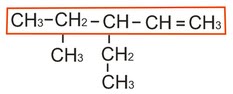
2. AlkenaAlkena merupakan senyawa hidrokarbon yang mengandung ikatan rangkap karbon-karbon. Alkena terdapat dalm jumlah berlebih di alam. Etilena, sebagai contohnya, adalah hormon tanaman yang memacu pematangan buah, dan α-pinen adalah senyawa terbanyak dalam turpentin. Contoh lainnya adalah beta karoten, mengandung sebelas ikatan rangkap dua, merupakan pigmen warna kuning yang mewarnai wortel. Beta karoten merupakan pro vitamin A.
Senyawa organohalogen (C, H, X dimana X = F, Cl, Br, atau I). Atom-atom halogen dapat dianggap sebagai pengganti hidrogen, jadi senyawa hidrokarbon seperti C4H6Br2 ekuivalen dengan C4H8, dengan demikian memiliki derajat ketidakjenuhan sama dengan satu.


3. Alkuna
Alkuna adalah senyawa jidrokarbon yang mengandung ikatan rangkap tiga karbon-karbon. Asetilena, adalah alkuna paling sederhana yang digunakan secara industrial sebagai bahan awal pembuatan asetaldehida, asam asetat, dan vinil klorida. Asetilena dibuat dari dekomposisi metana dalam suhu tinggi.
2 CH4 HC CH H2
12000C
+ 3
Metana Asetilena
Struktur Elektronik Alkun Ikatan rangkap tiga dihasilkan dari interaksi karbon-karbon
yang terhibridisasi sp. Ketika dua atom karbon yang terhibridisasi sp saling berinteraksi maka akan terbentuk satu ikatan σ dan dua ikatan π. Telah diketahui bahwa sudut ikatan pada karbon yang terhibridisasi sp adalah 1800, dengan demikian, asetilena C2H2, adalah molekul linear dengan sudut ikatan H C C sebesar 1800. Panjang ikatan karbon-karbon rangkap tiga sebesar 120 pm, dan kekuatan ikatannya sekitar 835 kJ/mol. Jadi ikatan karbonkarbon rangkap tiga memiliki panjang ikatan paling pendek dengan kekuatan paling besar. Hasil eksperimen memperlihatkan bahwa sekitar 318 kJ/mol energi dibutuhkan untuk memutus ikatan pi dalam alkuna, nilai ini kira-kira 50 kJ/mol lebih besar dari yang di butuhkan untuk memutuskan ikatan pi dalam alkuna.
Kegunaan Alkuna sebagai :
- etuna (asetilena = C2H2) digunakan untuk mengelas besi dan baja.
- untuk penerangan
TURUNAN HIDROKARBON
- Sintesis senyawa lain.Klasifikasi Gugus Fungsi
-
Berikut ini adalah beberapa gugus fungsi yang umum diketahui:1. AlkoholAlkanol atau Alkohol adalah gugus fungsi yang terdiri atas atom O dan H membentuk gugus -OH. Alkohol dapat membentuk Alkohol primer, sekunder, dan terisier tergantung ia mengikat di atom C apa. Bila alkohol mengikat di atom C primer, maka alkohol tersebut adalah alkohol primer, juga seterusnya. Alkohol memiliki akhiran -nolcontoh:CH3CH2OH (n-etanol)
CH3(CH2)3OH (n-butanol)
CH3CH2CHCH3OH (2-butanol)2. EterAlkoksi Alkana atau Eter adalah gugus fungsi Alkohol yang kehilangan atom H-nya membentuk gugus -O-, sehingga Eter mampu mengikat 2 gugus alkil yang berbeda. Eter memiliki Akhiran -oksi contoh:
CH3OCH3 (metoksi metana)
CH3CH2O(CH2)2CH3 (etoksi propana)
3. Aldehid
Alkanal atau Aldehid merupakan gugus fungsi yang terdiri dari atom C, O, dan H memebentuk gugus -COH. Aldehid memiliki akhiran -nal contoh:
HCOH (Metanal)
CH3CH2COH (Propanal)
4. Keton
Alkanon atau Keton merupakan gugus fungsi Aldehid yang kehilangan atom H-nya membentuk gugus -CO-, sehingga Keton mampu mengikat 2 gugus alkil lain yang berbeda. Keton memiliki akhiran -non contoh:
CH3COCH3 (2-Propanon)
5. Asam Karboksilat
Asam Alkanoat atau Asam Karboksilat merupakan gugus fungsi yang terdiri dari atom C, O, dan H serta O lainnya yang memiliki ikatan rangkap 2 sehingga membentuk gugus -COOH-. Asam Karboksilat memiliki akhiran -oat contoh:
CH3CH2COOH (Asam 1-Propanoat)
CH3(CH2)4COOH (Asam 1-Pentanoat)
6. Ester
Alkil Alkanoat atau Ester merupakan gugus fungsi Asam Karboksilat yang kehilangan atom H-nya sehingga membentuk gugus -COO- yang dapat mengikat 2 gugus alkil. Ester dapat dihasilkan dari reaksi Esterifikasi yaitu Reaksi antara Asam Karboksilat dengan Alkohol. Ester memiliki akhiran -il -oat contoh:
CH3COOCH3 (Metil Etanoat)
7. Amina
Gugus Fungsi Amina merupakan gugus fungsi yang berasal dari senyawa NH3 yang kehilangan 1 atom H menjadi -NH2 (Amina Primer) atau kehilangan 2 atom H menjadi -NH (Amina Sekunder) atau kehilangan seluruh atom Hnya menjadi -N (Amina Terisier). Amina memiliki akhiran -amina contoh:
CH3CH2NH2 (Etil Amina)
(CH3)3N (Trimetil Amina)
8. Haloalkana
Gugus Fungsi Haloalkana adalah Gugus Fungsi yang terdiri dari unsur-unsur Halogen seperti Fluor (F), Klor (Cl), Brom (Br), dan Iodin (I). Masing-masing gugus fungsi haloalkana hanya memiliki 1 tangan sehingga hanya bisa mengikat 1 gugus alkil. Haloalkana memiliki awalan Floro- untuk Fluor, Kloro- untuk Klor, Bromo- untuk Brom, dan Iodo- untuk Iodin. contoh:
CH3Cl (Klorometana)
CH3CHBrCH3 (2-Bromopropana)
Senyawa ini mengandung satu atau lebih rantai tertutup (cincin) yang dikenal dengan siklik dan terdiri atas dua jenis:
1) Senyawa homosiklik
Senyawa hidrokarbon siklik adalah senyawa karbon yang rantai
C nya melingkar dan lingkaran itu mungkin juga mengikat rantai samping.
Golongan ini terbagi lagi menjadi senyawa alisiklik dan aromatik. senyawa
alisiklik yaitu senyawa karbon alifatik yang membentuk rantai tertutup.
Senyawa heterosiklik aromatik adalah suatu
senyawa siklik di mana atom-atom yang terdapat dalam cincin terdiri atas dua
atau lebih unsur yang berbeda. Cincin heterosiklik dapat bersifat aromatik,
sama seperti pada cincin benzena. Senyawa heterosiklik banyak terdapat di alam
sebagai suatu alkaloid (seperti, morfin, nikotin dan kokain), asam-asam nukleat
(pengemban kode genetik), dan senyawa biologi lainnya.
Contoh:
Contoh-contoh senyawa tersebut tergolong senyawa heterosiklik.



izin menambahkan pada senyawa homosiklik,senyawa homosiklik merupakan senyawa siklik dimana atom-atom yang terdapat dalam cincin hanya terdapat satu unsur saja,terimaksih
BalasHapusterimakasih miranda atas sarannya, postingan selanjutnya akan dibuat lebih benar lagi
BalasHapussaya ingin sedikit memberikan saran tentang postingan yang telah anda buat menurut saya tulisan yang ada terlalu kecil dan banyak tulisan yang tidak dapat terbaca. sarannya harus lebih teliti sebelum memposting tugas yang anda buat karena blog banyak dibaca oleh banyak orang untuk mencari referensi tugas.
BalasHapusselamat siang elsa. saya ingin bertanya kepada saudari elsa, di postingan blog anda di jelaskan kegunaan alkuna itu salah satunya sebagai penerangan. nah senyawa alkuna mana yang di gunakan sebagai penerangan itu?
BalasHapussaya hanya ingin menambahkan yaitu Senyawa rantai tertutup.
BalasHapusRantai Tertutup/Siklik adalah hidrokarbon yang memiliki rantai yang saling berhubungan antar ujungnya (membentuk lingkaran), rantai tertutup juga dapat memiliki cabang. Rantai karbon tertutup dibagi menjadi 2 yaitu karbosiklik dan heterosiklik. Karbosiklik yaitu senyawa karbon yang rantai lingkarnya hanya terdiri atas atom C saja. Senyawa yang ternasuk karboskiklik yaitu senyawa aromatis dan senyawa alisiklik. Senyawa alisiklik adalah rantai tertutup yang tidak memiliki ikatan rangkap, atau hanya memiliki satu jenis ikatan rangkap. Senyawa alisiklik dapat diklasifikasikan menjadi Sikloalkana (tidak memiliki ikatan rangkap) dengan rumus umum CnH2n. Serta Sikloalkena (rangkap 2) dengan rumus umum CnH2n-2.