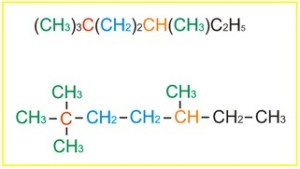
A..
Sistim nomenklatur
Idealnya, setiap senyawa organik harus memiliki nama yang dari sana dapat digambarkan suatu formula struktural dengan jelas.
Untuk komunikasi umum dan menghindari deskripsi yang panjang,
rekomendasi penamaan resmi IUPAC tidak selalu diikuti dalam prakteknya
kecuali jika diperlukan untuk memberikan definisi ringkas terhadap suatu senyawa atau jika nama IUPAC lebih sederhana (bandingkan etanol dengan etil alkohol). Jika tidak, maka nama umum atau nama trivial yang biasanya diturunkan dari sumber senyawa tersebutlah yang digunakan.
Tata nama
dalam alkana ditentukan berdasarkan atas sistem
IUPAC (International Union of
Pure Applied Chemistry). Suatu nama kimia terdiri atas awalan, induk, dan
akhiran. Nama awalan akan menerangkan substituennya, induk menerangkan panjang
rantai dan akhiran menunjukkan gugus fungsi.
Cara penamaan:
1.
Tentukan rantai karbon terpanjang dalam molekul,
dan pakai nama tersebut sebagai nama induknya.
2.
Penomoran rantai karbon dimulai dari yang
terdekat dengan titik cabang yang ada, sehingga akan memberikan nomor terkecil
dalam urutan.
3.
Identitas nomor dan substituen dari titik
percabangan dalam rantai utamanya. Jika ada dua substituen dalam atom C yang
sama, diberikan nomor yang sama pula.
4.
Tulis nama dengan tanda pemisah untuk awalan dan
menggunakan tanda koma untuk nomor. Jika ada dua substituen yang berbeda,
urutkan sesuai alfabet. Jika dua atau lebih substituen yang identik, diberi
nama pada awalan di-, tri-, dan tetra-
jika mengikuti aturan kaidah prioritas Cahn Ingold Prelog adalah
2-aminoetanol. Namun nama 2-hidroksietanaamina juga secara jelas merujuk
pada senyawa yang sama.
Nama senyawa diatas dikonstruksi dengan cara sebagai berikut:
Nama senyawa diatas dikonstruksi dengan cara sebagai berikut:
- Terdapat dua karbon pada rantai induk, maka diberi nama dasar "et"
- Karbon-karbon pada senyawa tersebut berikatan tunggal, maka diberi akhiran "an"
- Terdapat dua gugus fungsi pada senyawa tersebut, yakni alkohol (OH) dan amina (NH2). Alkohol memiliki nomor atom dan prioritas yang lebih tinggi dari amina, dan akhiran dari alkohol adalah "ol", maka akhiran majemuk yang terbentuk adalah "anol".
- Gugus amina tidak berada pada satu karbon yang sama dengan gugus OH (karbon nomor 1), namun melekat pada karbon nomor 2, oleh karena itu ia diidentifikasikan dengan awalan "2-amino".
- Setelah awalan, nama dasar, dan akhirannya digabung, kita mendapat "2-aminoetanol".
B. Isomer Struktural
Senyawa yang mempunyai rumus
molekul sama namun strukturnya berbeda disebut isomer. Senyawa yang strukturnya
berbeda akan mempunyai sifat-sifat kimia maupun fisika yang berbeda pula.
Beberapa macam isomer yang
berbeda-beda dapat dipelajari dan diketengahkan disini secara ringkas yaitu
isomer struktural yang meliputi:
a)
Isomer fungsional: seperti yang terjadi pada
setiap dua senyawa dimana mempunyai rumus molekul yang sama, tetapi mempunyai
perbedaan dalam gugus-gugus fungsionalnya.
Contoh:
C2H5 ─ O ─ C2H5 C4H9OH
dietil eter butil alkohol
b)
Isomer rangkaian atau struktural
H
Contoh:
│
CH3─CH2─ CH2 ─ CH3 CH3 ─C ─CH3
│
n-butana CH3
2-metil propana atau isobutana
c)
Isomer kedudukan: dalam hal ini kedudukan atau letak atom-atom
yang mensublimasi atau gugus-gugus substituen berbeda letaknya.
Contoh:
CH3-CH2-CH2-CH3 H
n-propanol │
CH3─ C ─ CH3
│
OH
Isopropil
alkohol
H
│
CH3─ C ─ CH2Br BrCH2─CH2─CH2Br
│
Br 1,3-dibromopropana
1,2-dibromopropana
Jenis-Jenis Isomer Struktur
- Isomer Rantai
Isomer ini muncul karena kemungkinan percabangan
rantai karbon. Sebagai contoh, ada dua isomer dari butana, C4H10.
Dalam salah satu dari mereka, atom karbon terletak pada “rantai lurus”
sedangkan yang lain rantai bercabang.
- Isomer Posisi
Dalam isomer
posisi , kerangka karbon dasar tetap tidak berubah, namun kelompok-kelompok
penting yang berpindah-pindah pada kerangka itu.
Sebagai contoh, ada dua isomer struktural dengan rumus molekul C3H7Br. Dalam salah satu dari mereka atom bromin di ujung rantai, sedangkan yang lain itu melekat di tengah.
Sebagai contoh, ada dua isomer struktural dengan rumus molekul C3H7Br. Dalam salah satu dari mereka atom bromin di ujung rantai, sedangkan yang lain itu melekat di tengah.
C. Isomer Alkana
Isomer adalah peristiwa di mana suatu senyawa karbon mempunyai rumus molekul sama tetapi struktur berbeda.
Contoh
Senyawa dengan rumus molekul C4H10 mempunyai dua struktur yang berbeda, yaitu:
Atau jika diungkapkan dalam bentuk model molekul
Perbedaan antara senyawa n-butana (baca:
normal butana) dengan metil propana adalah pada kerangka rantai
karbonnya. Rantai n-butana tidak bercabang, sedangkan metil propana
rantainya bercabang pada atom C-2. Perbedaan struktur kedua senyawa
tersebut mengakibatkan kedua sifat, di mana titik didih n-butana adalah
-0,4oC sedangkan titik didih metil propana adalah -11,6oC.
Semakin banyak jumlah atom karbon penyusun alkana, semakin banyak jumlah isomer alkana -nya.
D. mengapa sudut
ikatan H-C-H lebih kecil dari H-C-C?
Jawab:
Pada posisi
tereksitasi, karbon memiliki empat elektron tak berpasangan dan dapat
membentuk empat ikatan dengan hidrogen. Meskipun membutuhkan energi
sebesar 96 kkal/mol untuk mengeksitasi satu elektronnya terlebih dahulu,
ikatan yang terbentuk dengan H (pada CH4) jauh lebih stabil dibandingkan
ikatan C-H pada molekul
CH2. Selain itu, Karena bentuk molekul H-C-C adalah polal linier di mana
atom-atomnya tertata pada suatu garis lurus,sudut yang dibentuk oleh dua ikatan
ke arah atom pusat akan saling membentuk dusut 180.sudut itu disebut sudut
ikatan, seperti contohnya BeCL2 Ikatan C-H pd metana memiliki kekuatan ikatan 104 kkal/mol dengan
panjang ikatan 1.10 A. sudut ikatan H-C-H sebesar 109.5 derajat. Sedangkan Orbital sp memiliki bangun ruang linear dengan sudut ikatan HC-C sebesar
180 derajat yang telah terverifikasi dari hasil eksperimental. Panjang
ikatan hidrogen-karbon sebesar 1.06A dan panjang ikatan karbon-karbon adalah 1.20 A.